Ver voorbij de golflengtelimiet
De opstelling in het oude gebouw van Technische Natuurwetenschappen De opstelling in het oude gebouw van Technische Natuurwetenschappen (TNW) is een optische microscoop, maar deze heeft weinig meer weg van de klassieke samenstelling van objectief, oculair en scherpstelschroef in een gebogen statief. Hier zit het objectief onder de preparaattafel en het oculair is vervangen door een supergevoelige en snelle zwartwit-camera. De techniek om met optische microscopie kleinere details dan de golflengte waar te nemen stamt uit 2006. Volgens de klassieke fysica kan dat niet, maar single molecule localisation microscopy (SMLM) maakt van een microscoop feitelijk een nanoscoop. De ontwikkelaars (Eric Betzig, Stefan Hell en William Moerner) ontvingen er in 2014 de Nobelprijs voor Chemie voor. In Delft werken prof.dr. Bernd Rieger en prof.dr. Sjoerd Stallinga (TNW) met deze techniek om biomoleculen zichtbaar te maken. Het is hun missie om steeds meer details waarneembaar te maken van biomoleculen in hun natuurlijke omgeving. Daarbij opereren ze aan de rand van wat fysisch en technisch mogelijk is. Houdt gewone lichtmicroscopie op bij 250 nanometer (nm), de details bij SMLM zijn nu rond 10 tot 20 nm en de Delftse onderzoekers streven naar ‘enkele nanometers.’
Poortmolecuul
Bij hun vormstudie naar celkernpori.n hebben ze oplichtende moleculen (fluoroforen) toegevoegd die zich hechten op de binnen- en buitenrand van het poortmolecuulcomplex. Nu heeft een celkern al gauw duizend pori.n die allemaal kunnen oplichten. De belichtingstijd duurt ongeveer een uur. Dan zijn er honderden afbeeldingen van celkernpori.n in alle mogelijke orintaties. Daaruit kunnen Rieger en Stallinga de ruimtelijke vorm van het poortmolecuul laten berekenen. Die berekening van data fusion of particle averaging vergt enkele uren rekentijd. Het resultaat is een ruimtelijk beeld van een celkernporie met afmetingen tot op de nanometer (59 nm diep en 96 nm wijd). Ze gaven de oriëntatie weer met een kleurcode en konden op die manier de draaiing van twee strengen DNA weergeven als repeterende kleurpatronen. Het was de eerste keer dat DNA-twisting met licht zichtbaar werd gemaakt. Afgelopen voorjaar (2022) ontving Stallinga een Europese onderzoeksbeurs (ERC advanced grant) voor zijn voorstel om scannen met niet-uniforme belichting te gebruiken. Hiermee hoopt hij de superresolutie-microscopie nog preciezer te maken en daarbij bovendien een groter volume te bestrijken.
DNA-twist
Wanneer een fluorofoor licht uitzendt, gebeurt dat niet naar alle kanten even sterk. De ruimtelijke verdeling van de lichtintensiteit lijkt meer op een halter dan op een bol. Promovendi van Stallinga en Rieger bedachten dat die ‘anisotropie’ de mogelijkheid biedt om de orientatie van een molecuul af te leiden uit de lichtsterkte. Ze gaven de oriëntatie weer met een kleurcode en konden op die manier de draaiing van twee strengen DNA weergeven als repeterende kleurpatronen. Het was de eerste keer dat DNA-twisting met licht zichtbaar werd gemaakt. Afgelopen voorjaar (2022) ontving Stallinga een Europese onderzoeksbeurs (ERC advanced grant) voor zijn voorstel om scannen met niet-uniforme belichting te gebruiken. Hiermee hoopt hij de superresolutie-microscopie nog preciezer te maken en daarbij bovendien een groter volume te bestrijken.

©Sam Rentmeester
Bernd Rieger en Sjoerd Stallinga maken biomoleculen zichtbaar.
Het was de eerste keer dat DNA-twisting met licht zichtbaar werd gemaakt
©Sam Rentmeester
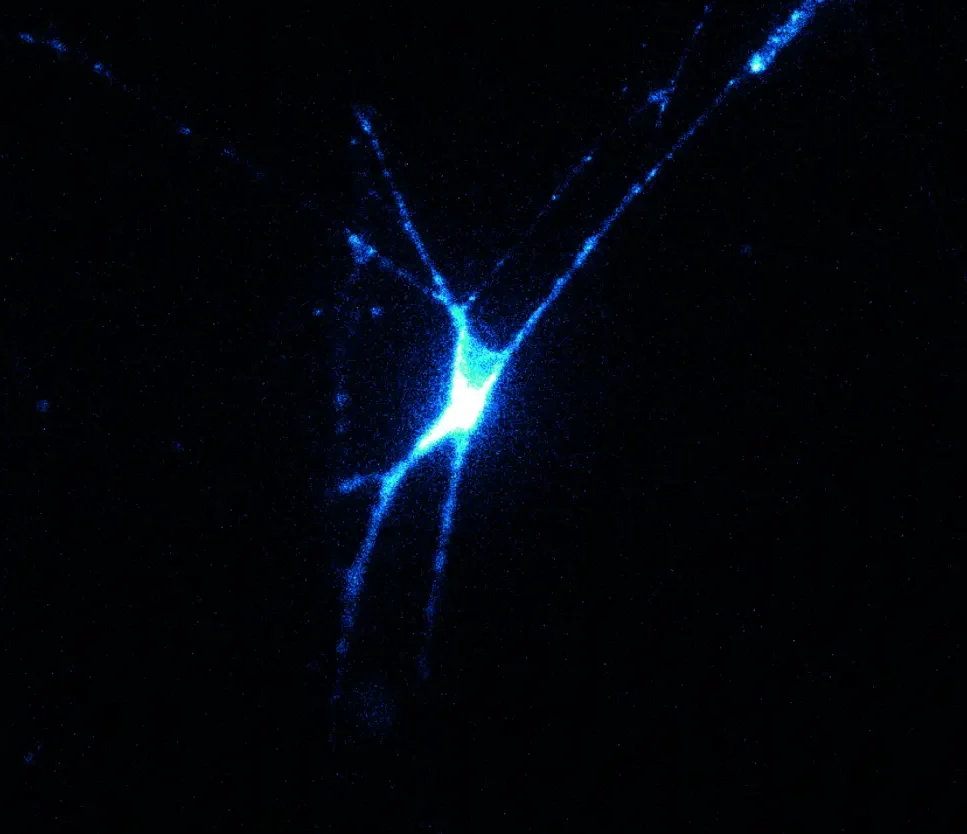
Microscoopbeeld van een zenuwcel met een fluorescente voltagesensor.
© Tijn Hoekstra
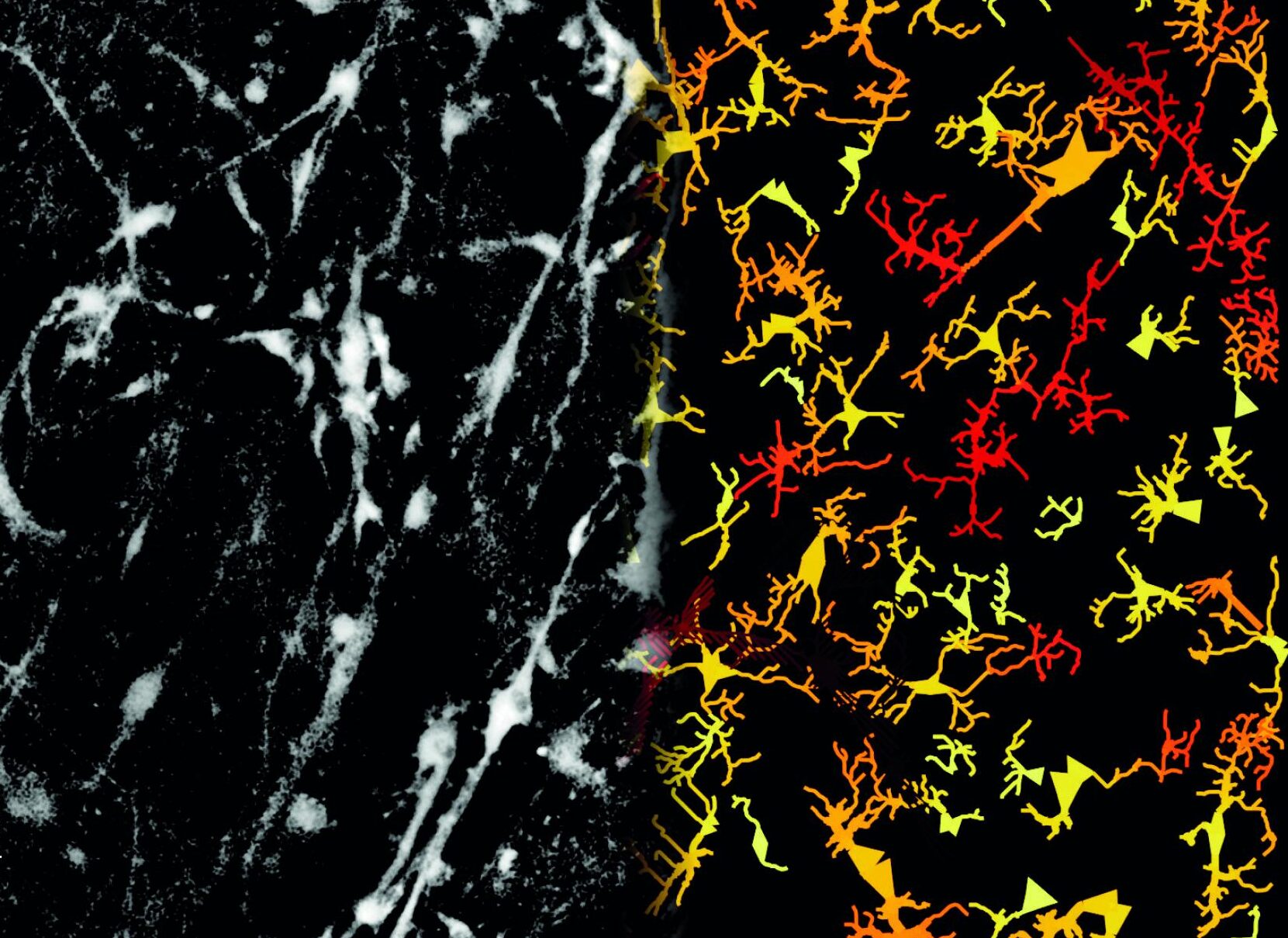
Microscoopbeeld van een neuraal netwerk (links) en de daaruit afgeleide computationele structuur (rechts).
Onderzoekers kunnen met deze techniek in het levende brein van een muis kijken

© Sam Rentmeester
Daan Brinks maakt met de zogenaamde optogenetica techniek de activiteit van het zenuwnetwerk zichtbaar.
Na dagen tot weken rekenwerk verschijnt een onwaarschijnlijk scherp 3D-beeld van het eiwit

© Sam Rentmeester
Arjan Jakobi is gespecialiseerd in Cryo-EM, waarbij de smalle elektronenbundel van de elektronenmicroscoop gericht is op een diepgevroren eiwit-preparaat.
Het brein aan het werk zien
Het is een merkwaardig filmpje dat dr.ir. Daan Brinks laat zien. Hij leidt The Brinks Lab met laboratoria aan de TU Delft en het Erasmus MC in Rotterdam. De slogan van zijn lab is image the brain at work en dat is precies wat het filmpje laat zien: lichtflitsen die door een netwerk van zenuwcellen trekken. Het is geen animatie die je ziet. De slogan heeft het niet over ‘imagine’ (verbeelding) maar over ‘image’ (beeldvorming). De video is een slow-motion optische microscoop-opname van pulsjes die door een levend neuraal netwerk trekken. Met ‘voltage imaging’ maakt het Brinks Lab niet zozeer de structuur van zenuw-netwerken zichtbaar, maar de activiteit. Maar hoe dan? De elektrische pulsen worden veroorzaakt door korte laserflitsen (ongeveer een milliseconde). Dat gaat via een techniek met de naam ‘optogenetica’. Die techniek is zo slim en veelzijdig dat zowel Nature als Science het in 2010 als ‘methode van het jaar’ (respectievelijk decennium) uitriepen. Een laserflits triggert een actiepotentiaal doordat de zenuwcel een lichtgevoelig ionenkanaal bevat. Zodra dat moleculair complex een lichtflits krijgt, stromen ionen naar binnen die een actiepotentiaal veroorzaken. Dat verspreidt zich over de vertakkingen naar aangrenzende neuronen. Van nature heeft een cel niet zo’n lichtgevoelige poort, maar de cel legt deze aan na een virale infectie met synthetisch DNA. “We brengen het synthetische DNA naar binnen via een virus”, legt Brinks uit. “Dat geeft de mogelijkheid om heel specifiek bepaalde cellen te veranderen.”
Moleculaire voltmeters
Daarmee is nog niet verklaard hoe potentiaal-verandering zichtbaar wordt. Het Brinks Lab ontwikkelt daarvoor moleculaire voltmeters: fluorescerende eiwitten (archaerhodopsine) die meer licht uitzenden naarmate de elektrische spanning over het molecuul hoger is. Het idee van moleculaire voltmeters is al een aantal decennia oud, maar de eerste werkende versies zijn de afgelopen jaren ontwikkeld in het lab van Adam Cohen op Harvard, waar Brinks zijn postdoc gedaan heeft. Brinks’ lab op de TU Delft ontwikkelt nu slimme microscopen en betere moleculaire voltmeters om de techniek bruikbaar te maken voor neurowetenschappelijk onderzoek en klinische diagnostiek. In het Erasmus MC kunnen onderzoekers met deze techniek in het levende brein van een muis kijken. Ze proberen te zien wat er in het patroon van lichtflitsen verandert als de muis een nieuw trucje leert zoals op commando een likje geven of met de ogen knipperen. Brinks heeft het over ‘de biofysische manifestatie van het leerproces’. Brinks is op zoek naar ‘de natuurkundige grondslag van het brein’. Aanvullend op de psychologie en anatomie is hij met zijn lab op zoek naar wat er op fysisch cellulair niveau gebeurt. Als voorbeeld noemt hij de studie van zenuwcellen van een ALS-patiënt, gekweekt uit stamcellen. Anders dan gezonde zenuwcellen geven ALS neuronen bij een toenemende prikkel niet meer signaal af, maar juist minder. En vallen stil. De vraag is: waarom precies?
Freeze! – eiwitten in een elektronenbundel
Eiwitten zijn de multitool van levende cellen. Ze bouwen en repareren lichaamsweefsel, maken biochemische reacties mogelijk, verzorgen communicatie en geven structuur aan cellen. Om maar wat te noemen. Ze zijn samengesteld uit lange ketens aminozuren (slechts twintig verschillende) en verlenen hun werking aan hun vorm. Die vorm wordt bepaald door de vouwing van het eiwit in een waterige omgeving: hydrofobe (waterafstotende) delen plakken aan elkaar en vormen de kern. Hydrofiele delen vormen de buitenkant. Onderzoekers willen graag zo precies mogelijk de ruimtelijke vorm van eiwitten weten. Dat stelt bijvoorbeeld farmaceuten in staat een klein molecuul te ontwerpen dat een bepaald eiwit blokkeert en ongewenste processen (zoals besmetting) stopt. De meest precieze microscoop is de elektronenmicroscoop, maar de omgeving van de vacuümkamer en de elektronenbundel zijn desastreus voor eiwitten. Zie hier de uitdaging van een bijzondere tak van microscopie Cryo-EM – het specialisme van dr. Arjen Jakobi (afdeling bionanoscience van het Kavli instituut voor nanowetenschap, TNW). Bij Cryo-EM is de smalle elektronenbundel gericht op een diepgevroren (cryogeen) eiwitpreparaat. En dat heeft nogal wat voeten in de aarde. Twee jaar geleden ontving Jakobi een Europese onderzoeksbeurs (ERC starting grant) om zijn onderzoeksgroep op te starten. Dit jaar volgde nóg een ERC-beurs voor de ontwikkeling van een cryo-chip om de beeldvorming efficiënter te maken.
Razendsnel bevriezen
“Een eiwit is een gevoelig molecuul dat alleen in een waterige omgeving zijn natuurlijke vorm heeft”, vertelt Jakobi. “Maar water in de elektronenmicroscoop zou door het vacuüm onmiddellijk verdampen en bovendien moeten we de eiwitten fixeren.” Dit probleem kun je oplossen door de in vloeistof opgeloste eiwitten te bevriezen. Dat moet razendsnel gebeuren (binnen een milli-seconde van 20 naar minus 200 graden Celsius), anders vormen zich ijskristallen die de eiwitten vervormen. Voor het bevriezen heeft de groep een opstelling die het preparaat als een dolk in vloeibaar ethaan stoot. Van daaruit gaat het (in een bakje vloeibaar stikstof) naar de elektronenmicroscoop. De bundelintensiteit staat minimaal om de eiwitten niet te beschadigen. Het beeld is dan ook vrijwel egaal grijs, maar het bevat toch schaduwen van honderd-duizenden moleculen in alle mogelijke standen. Die bevinden zich in een dun laagje ijs van 20 tot 100 nanometer ‘dik’. Het rekenproces om uit al die tienduizenden projecties de ruimtelijke vorm van het eiwit te herleiden wordt back projection genoemd. Na dagen tot weken rekenwerk verschijnt dan een onwaarschijnlijk scherp 3D-beeld van het eiwit waarin je de afzonderlijke atomen haast kunt onderscheiden. Jakobi’s werkt eraan om ook bewegingen van eiwitten vast te leggen, en interacties met andere moleculen. “Dan begrijp je pas goed hoe een eiwit zijn functie vervult.”
Op 13 januari 2023 zullen Bernd Rieger en Sjoerd Stallinga over hun werk spreken tijdens de 181ste Dies Natalis van de TU Delft. Deze presentatie is online te volgen.

